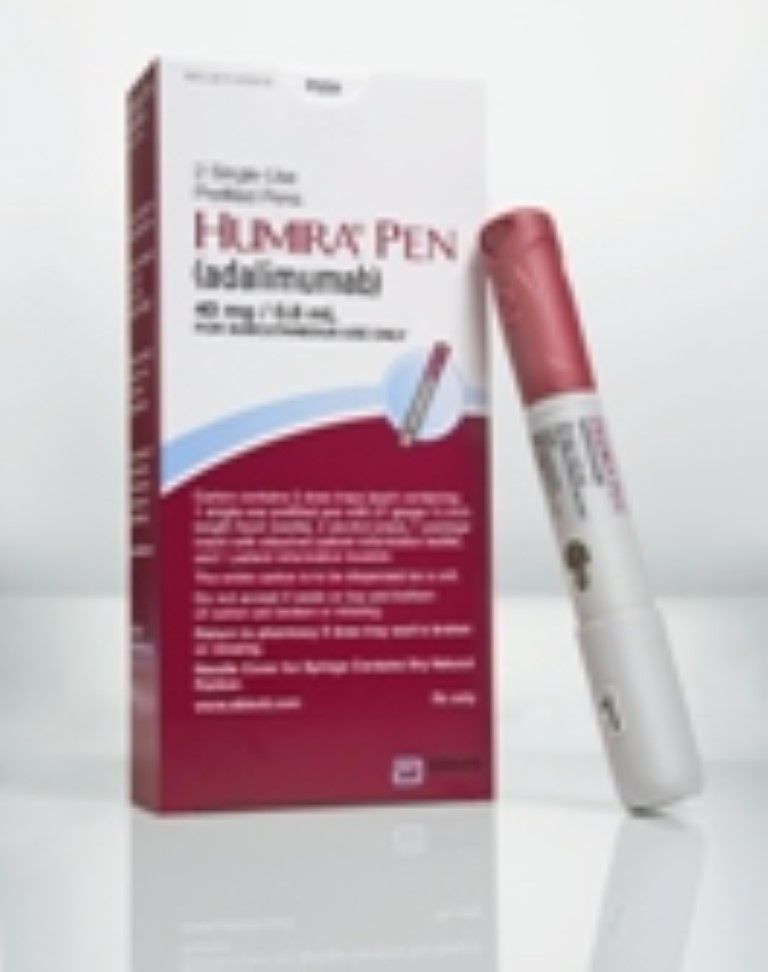
Adalimumab, beter bekend als Humira, is een biologisch geneesmiddel dat werkt door een eiwit te blokkeren dat bekend is als TNF-alfa. Normaal gesproken helpt TNF-alfa infecties te bestrijden, maar in overmatige hoeveelheden kan het pijnlijke ontsteking en ernstige gewrichtsschade (d.w.z. veel voorkomende symptomen van reumatoïde artritis en andere vormen van ontstekingsarthritis) veroorzaken. Geneesmiddelen zoals Humira hebben veel patiënten met reumatoïde artritis geholpen door pijn te verzachten, de gewrichtsfunctie te verbeteren en de progressie van de ziekte te vertragen.
Overzicht
Humira is een volledig gehumaniseerd monoklonaal antilichaam. Dit betekent dat, hoewel het gemaakt is in niet-menselijke biologische systemen, de eigenlijke eiwitmake-up van het medicijn identiek is aan dat van menselijke antilichamen. En deze vooraanstaande Humira van de TNF-remmer van het monoklonale antilichaam die daarvoor was goedgekeurd – de eiwitsamenstelling was deels afkomstig van een niet-menselijk (muis) antilichaam.
In 2002 werd Humira voor het eerst goedgekeurd door de Amerikaanse Food and Drug Administration (FDA) als een behandeling voor reumatoïde artritis. Het is een van de verschillende biologische geneesmiddelen die TNF-alfa blokkeren, waaronder:
- Enbrel (Etanercept): het eerste anti-TNF-medicijn dat door de FDA is goedgekeurd voor reumatoïde artritis en bepaalde inflammatoire vormen van artritis in 1998.
- Remicade (Infliximab): De tweede TNF-remmer moet in 1999 door de FDA worden goedgekeurd.
- Simponi (Golimumab): door de FDA goedgekeurd op 24 april 2009.
- Cimzia (Certolizumab Pegol): door de FDA goedgekeurd op 14 mei 2009.
Dosing
Humira wordt gegeven door subcutane (onder de huid) zelfinjectie eens in de twee weken. Patiënten kunnen door hun arts worden geadviseerd om het elke week te injecteren als elke 14 dagen niet genoeg is.
Het was voor het eerst verkrijgbaar in een voorgevulde spuit voor eenmalig gebruik. Voor eenmalig gebruik is ook het wegwerpafgiftesysteem ontwikkeld, de Humira Pen.
De aanbevolen dosis is echter 40 mg als een subcutane zelfinjectie met de voorgevulde spuit of Humira-pen om de andere week. Methotrexaat, andere niet-biologische DMARD’s, glucocorticoïden, niet-steroïde ontstekingsremmende geneesmiddelen (NSAID’s) of analgetica (pijnstillers) kunnen worden voortgezet tijdens de behandeling met Humira. Andere biologische DMARD’s mogen echter niet worden gebruikt.
Indicaties
Er zijn meer indicaties toegevoegd voor Humira sinds het oorspronkelijk werd goedgekeurd door de FDA. Het kan worden voorgeschreven om ook te behandelen:
- Reumatoïde artritis
- Spondylitis ankylopoetica
- Artritis psoriatica
- Juveniele idiopathische artritis
- Plaque Psoriasis
- Colitis ulcerosa
- Volwassene en kinderen Crohn’s ziekte
- Hidradenitis Suppurativa
Bijwerkingen
Vaak voorkomende bijwerkingen van Humira zijn onder andere:
- Milde reactie op de injectieplaats
- Uitslag
- Hoofdpijn
- Maagklachten of misselijkheid
- Longontsteking
Bijwerkingen
Omdat het de immuunrespons in het lichaam onderdrukt die normaal infecties bestrijdt, is Humira in verband gebracht met ernstige infecties, zoals tuberculose, sepsis en schimmelinfecties . Het kan ook de symptomen van ziekten van het zenuwstelsel verergeren (bijv. Demyeliniserende aandoeningen). In klinische onderzoeken hadden sommige patiënten een hogere frequentie van kanker en lymfoom gedurende een periode van 24 maanden.
Wie mag Humira niet gebruiken
Humira mag niet worden gebruikt door patiënten met een bekende allergie voor het geneesmiddel of de componenten ervan. Het mag ook niet worden gebruikt door patiënten die zwanger zijn of borstvoeding geven.
Het medicijn mag niet worden voorgeschreven aan een patiënt met een actieve infectie of aan patiënten die vatbaar zijn voor infecties, waaronder patiënten met ongecontroleerde diabetes of patiënten met een voorgeschiedenis van terugkerende infecties.
Vertel het uw arts
- Als u een actieve infectie heeft
- Als u bent geïnfecteerd met hepatitis B of drager bent (Humira is in verband gebracht met de reactivering van hepatitis B)
- Als u gevoelloosheid, tinteling of multiple sclerose of een stoornis van het centrale zenuwstelsel heeft
- Als u bent behandeld voor hartfalen
- Voordat u een vaccin of een operatie krijgt
Om vermoedelijke bijwerkingen te melden, kunt u contact opnemen met AbbVie Inc.at 1-800- 633-9110 of de FDA op 1-800-FDA-1088 of www.fda.gov/medwatch.